Une récente étude a révélé que la taurine, un acide aminé présent dans l’organisme, semblait avoir des propriétés bénéfiques pour la santé de certains mammifères, notamment les souris et les singes, en ralentissant le vieillissement.
L’efficacité de la taurine chez l’humain n’a pas encore été démontrée, et pourtant, on la retrouve depuis longtemps dans de nombreuses boissons énergisantes. Mais d’où cela vient-il, et quels en sont les effets?
Source : La taurine, ingrédient miracle des boissons énergisantes? | Slate.fr
Carence en taurine comme moteur du vieillissement
Résumé de l’éditeur
Le vieillissement est associé à des changements physiologiques qui varient en échelle des organites aux systèmes d’organes, mais nous travaillons toujours à comprendre la base moléculaire de ces changements. Étudier divers animaux, Singh et al. a constaté que la quantité de taurine d’acide aminé semi-essentiel en circulation a diminué avec l’âge ( voir la perspective de McGaunn et Baur ). La supplémentation en taurine a ralenti les principaux marqueurs du vieillissement tels que l’augmentation des dommages à l’ADN, le déficit en télomérase, la fonction mitochondriale altérée et la sénescence cellulaire. La perte de taurine chez l’homme était associée à des maladies liées au vieillissement et les concentrations de taurine et de ses métabolites augmentaient en réponse à l’exercice. La supplémentation en taurine a amélioré la durée de vie des souris et la durée de vie des singes. — L. Bryan Ray
Résumé structuré
INTRODUCTION
Le vieillissement est un processus multifactoriel inévitable. Les changements liés au vieillissement se manifestent par le fait que les “ caractéristiques du vieillissement, ” provoquent le déclin des fonctions des organes et augmentent le risque de maladie et de décès. Le vieillissement est associé à des changements systémiques des concentrations de molécules telles que les métabolites. Cependant, que de tels changements ne soient que la conséquence du vieillissement ou que ces molécules soient les moteurs du vieillissement reste largement inexploré. S’il s’agissait de moteurs du vieillissement à base de sang, le rétablissement de leur concentration ou de leurs fonctions à des niveaux “ jeunes ” pourrait servir d’intervention anti-âge.
RATIONALE
La taurine, un micronutriment semi-essentiel, est l’un des acides aminés les plus abondants chez l’homme et les autres eucaryotes. Des études antérieures ont montré que la concentration de taurine dans le sang est en corrélation avec la santé, mais on ne sait pas si les concentrations de taurine sanguine affectent le vieillissement. Pour combler cet écart de connaissances, nous avons mesuré la concentration sanguine de taurine pendant le vieillissement et étudié l’effet de la supplémentation en taurine sur la durée de vie et la durée de vie de plusieurs espèces.
RÉSULTATS
La concentration sanguine de taurine diminue avec l’âge chez la souris, le singe et l’homme. Pour déterminer si cette baisse contribue au vieillissement, nous avons alimenté oralement de la taurine ou une solution de contrôle une fois par jour à des femmes et des hommes d’âge moyen C57Bl / 6Jsouris jusqu’à la fin de la vie. Les souris nourries à la taurine des deux sexes ont survécu plus longtemps que les souris témoins. La durée de vie médiane des souris traitées à la taurine a augmenté de 10 à 12% et l’espérance de vie à 28 mois a augmenté d’environ 18 à 25%. Une thérapie anti-âge significative devrait non seulement améliorer la durée de vie, mais aussi la durée de vie saine, la période de vie saine. Nous avons donc étudié la santé des souris d’âge moyen nourries à la taurine et trouvé un meilleur fonctionnement des os, des muscles, du pancréas, du cerveau, des graisses, des intestins et du système immunitaire, indiquant une augmentation globale de la durée de vie. Nous avons observé des effets similaires chez les singes. Pour vérifier si les effets observés de la taurine ont transcendé la limite de l’espèce, nous avons examiné si la supplémentation en taurine augmentait la durée de vie des vers et de la levure. Bien que la taurine n’ait pas affecté la durée de vie réplicative de la levure unicellulaire,il a augmenté la durée de vie des vers multicellulaires. Les enquêtes sur le ou les mécanismes par lesquels la supplémentation en taurine a amélioré la durée de vie et la durée de vie ont révélé que la taurine affectait positivement plusieurs caractéristiques du vieillissement. La taurine a réduit la sénescence cellulaire, protégée contre la carence en télomérase, supprimé la dysfonction mitochondriale, diminué les dommages à l’ADN et atténué l’inflammation. Une analyse d’association des facteurs de risque cliniques des métabolites chez l’homme a montré que la taurine, l’hypotaurine et suppression de la dysfonction mitochondriale, diminution des dommages à l’ADN et atténuation de l’inflammation. Une analyse d’association des facteurs de risque cliniques des métabolites chez l’homme a montré que la taurine, l’hypotaurine et suppression de la dysfonction mitochondriale, diminution des dommages à l’ADN et atténuation de l’inflammation. Une analyse d’association des facteurs de risque cliniques des métabolites chez l’homme a montré que la taurine, l’hypotaurine et NLes concentrations de -acétyltaurine étaient associées à une santé défavorable, telle qu’une augmentation de l’obésité abdominale, une hypertension, une inflammation et une prévalence du diabète de type 2. De plus, nous avons constaté qu’un épisode d’exercice augmentait les concentrations de métabolites de la taurine dans le sang, ce qui pourrait sous-tendre partiellement les effets anti-âge de l’exercice.
CONCLUSION
L’abondance de taurines diminue pendant le vieillissement. Un renversement de ce déclin par la supplémentation en taurine augmente la durée de vie et la durée de vie des souris et des vers et la durée de vie des singes. Cela identifie la carence en taurine comme un moteur du vieillissement de ces espèces. Pour tester si la carence en taurine est également un moteur du vieillissement chez l’homme, des essais de supplémentation en taurine à long terme et bien contrôlés qui mesurent la durée de vie et la durée de vie au fur et à mesure que les résultats sont nécessaires.
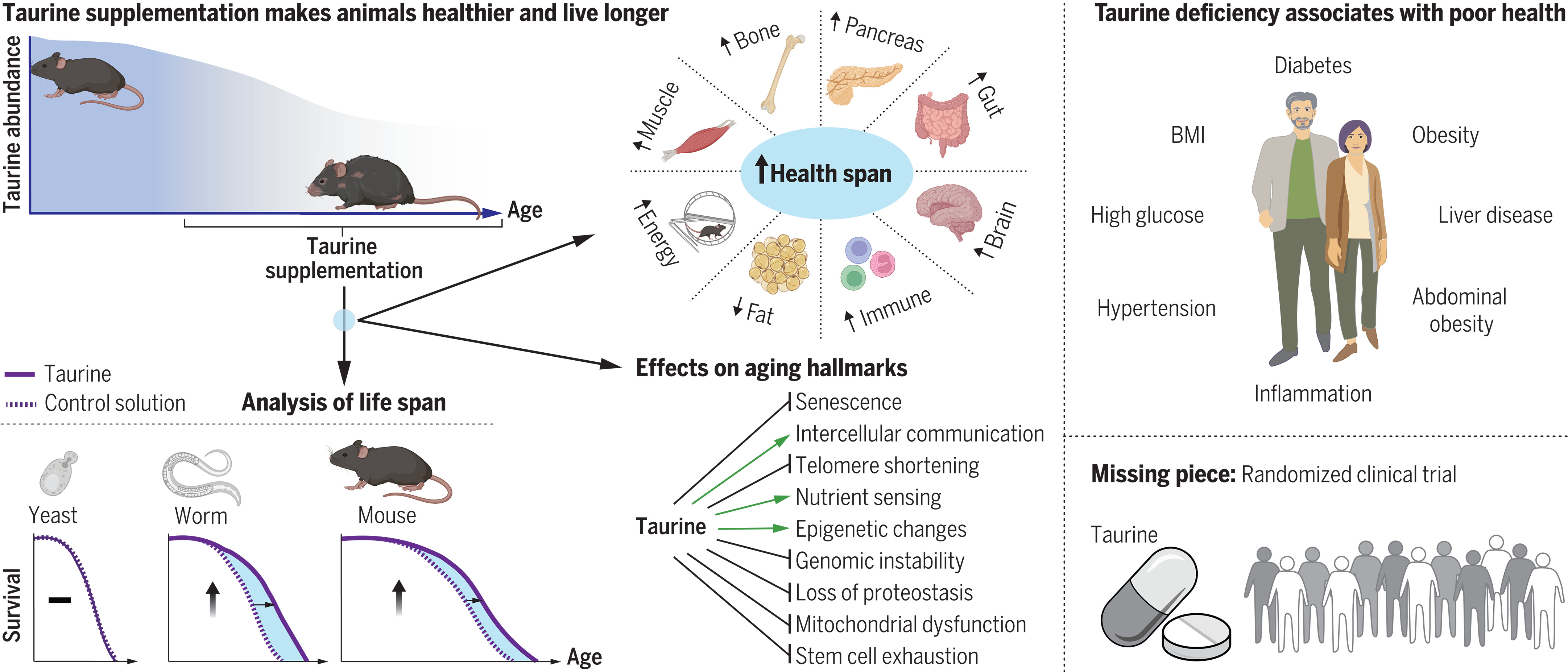
Carence en taurine comme moteur du vieillissement.
La concentration de taurine dans le sang diminue avec le vieillissement ( en haut à gauche ). Une inversion de cette goutte à travers la supplémentation en taurine a augmenté la durée de vie saine chez les souris et les vers mais pas chez les levures ( en bas à gauche et en haut au milieu ). La supplémentation en taurine a affecté plusieurs caractéristiques du vieillissement ( moyen ). Chez l’homme, des concentrations plus faibles de taurine ont été associées à plusieurs maladies ( en haut à droite ). Un essai clinique contrôlé randomisé chez l’homme est justifié pour évaluer les effets anti-âge de la taurine ( en bas à droite ). IMC, indice de masse corporelle.
Résumé
Le vieillissement est associé à des changements dans les niveaux de circulation de diverses molécules, dont certaines restent indéfinies. Nous constatons que les concentrations de taurine en circulation diminuent avec le vieillissement chez la souris, le singe et l’homme. Un renversement de ce déclin par la supplémentation en taurine a augmenté la durée de vie ( la période de vie saine ) et la durée de vie chez la souris et la durée de vie chez le singe. Mécaniquement, la taurine a réduit la sénescence cellulaire, protégée contre la carence en télomérase, supprimé la dysfonction mitochondriale, diminué les dommages à l’ADN et atténué l’inflammatoire. Chez l’homme, les concentrations de taurine plus faibles corrélées à plusieurs maladies liées à l’âge et les concentrations de taurine ont augmenté après un exercice d’endurance aigu. Ainsi, une carence en taurine peut être un moteur du vieillissement car son inversion augmente la durée de santé des vers, des rongeurs,et les primates et la durée de vie des vers et des rongeurs. Les essais cliniques chez l’homme semblent justifiés de tester si une carence en taurine pourrait entraîner le vieillissement chez l’homme.
Selon les Perspectives de la population mondiale des Nations Unies, le nombre de personnes âgées de 65 ans et plus passera de 1 personne sur 11 en 2019 à 1 personne sur 6 en 2050 (1). Bien qu’il s’agisse d’un succès de la médecine moderne et des politiques gouvernementales, il est essentiel de veiller à ce que les personnes âgées restent également en bonne santé, car cela augmentera la qualité de vie et réduira les coûts associés au vieillissement sociétal (2–5). Au cours des deux dernières décennies, les efforts visant à identifier les interventions anti-âge qui réduisent la morbidité et augmentent la durée de vie se sont intensifiés (2–11). Cela a conduit à l’identification de composés susceptibles d’augmenter la durée de vie saine ( la période de vie passée en bonne santé ) tels que la rapamycine, la metformine, le nicotinamide adénine dinucléotide ( NAD ) précurseurs, et sénolytiques (2–6, 12).
Le vieillissement est un processus complexe qui affecte tous les organes (13, 14). Le déclin induit par l’âge des fonctions des organes implique plusieurs événements autonomes cellulaires appelés “ caractéristiques du vieillissement. ” Les caractéristiques centrales comprennent l’instabilité génomique, la détection des nutriments déréglementée, la dysfonction mitochondriale, l’épuisement des cellules souches et l’accumulation de cellules sénescentes (13). Le déclin des fonctions des organes associé au vieillissement résulte également de changements dans les concentrations de métabolites endogènes, d’hormones et de micronutriments dans le sang (15–17). Cependant, il n’est pas clair si ces changements sont des passagers ou des conducteurs du vieillissement. Si une molécule dans le sang est un moteur du vieillissement, une correction de ses niveaux de jeunesse retarderait le vieillissement et augmenterait la durée de vie saine.
La taurine ( 2 – acide aminoéthanesulfonique ), un micronutriment semi-essentiel, est l’un des acides aminés les plus abondants présents dans les organismes à travers le phyla eucaryote (18–22). Dans les cellules de mammifères, la taurine est produite à partir de cystéine par l’action de la décarboxylase à l’acide sulfinique cystéine ( CSAD ) (20). La taurine peut également être obtenue à partir de l’alimentation et est absorbée par les cellules par les transporteurs de taurine (20). La carence en taurine au début de la vie provoque des troubles fonctionnels du muscle squelettique, de l’œil et du système nerveux central (23–26) qui sont liés à des troubles associés au vieillissement. De plus, les concentrations de taurine et de ses métabolites diminuent dans certains tissus avec l’âge, et la supplémentation aiguë en taurine chez les jeunes animaux améliore les fonctions de plusieurs organes (27–35). Compte tenu du déclin de l’abondance de la taurine pendant le vieillissement et de ses effets sur la santé connus, nous avons cherché à savoir si la carence en taurine est un moteur du vieillissement et affecte la durée de vie saine.
Résultats
Déclin des concentrations sériques de taurine avec l’âge chez la souris, le singe et l’homme
Pour étudier de manière approfondie si l’abondance de la taurine influence une durée de vie saine, nous avons mesuré les concentrations de taurine sanguine à différents âges chez la souris, le singe et l’homme. Dans C57Bl / 6J souris de type sauvage ( WT ), les concentrations sériques de taurine sont passées de 132,3 ± 14,2 ng / ml à 4 semaines à 40,2 ± 7,1 ng / ml à 56 semaines, qui est en corrélation négative avec la pente ( = − 25,7; p < 2 × 10− 16) (Fig. 1A). Chez les singes de 15 ans, les concentrations sériques de taurine étaient de 85% inférieures à celles des singes de 5 ans (Fig. 1B). De même, les concentrations de taurine chez les personnes âgées ont diminué de plus de 80% par rapport à la concentration sérique des individus plus jeunes (Fig. 1C).
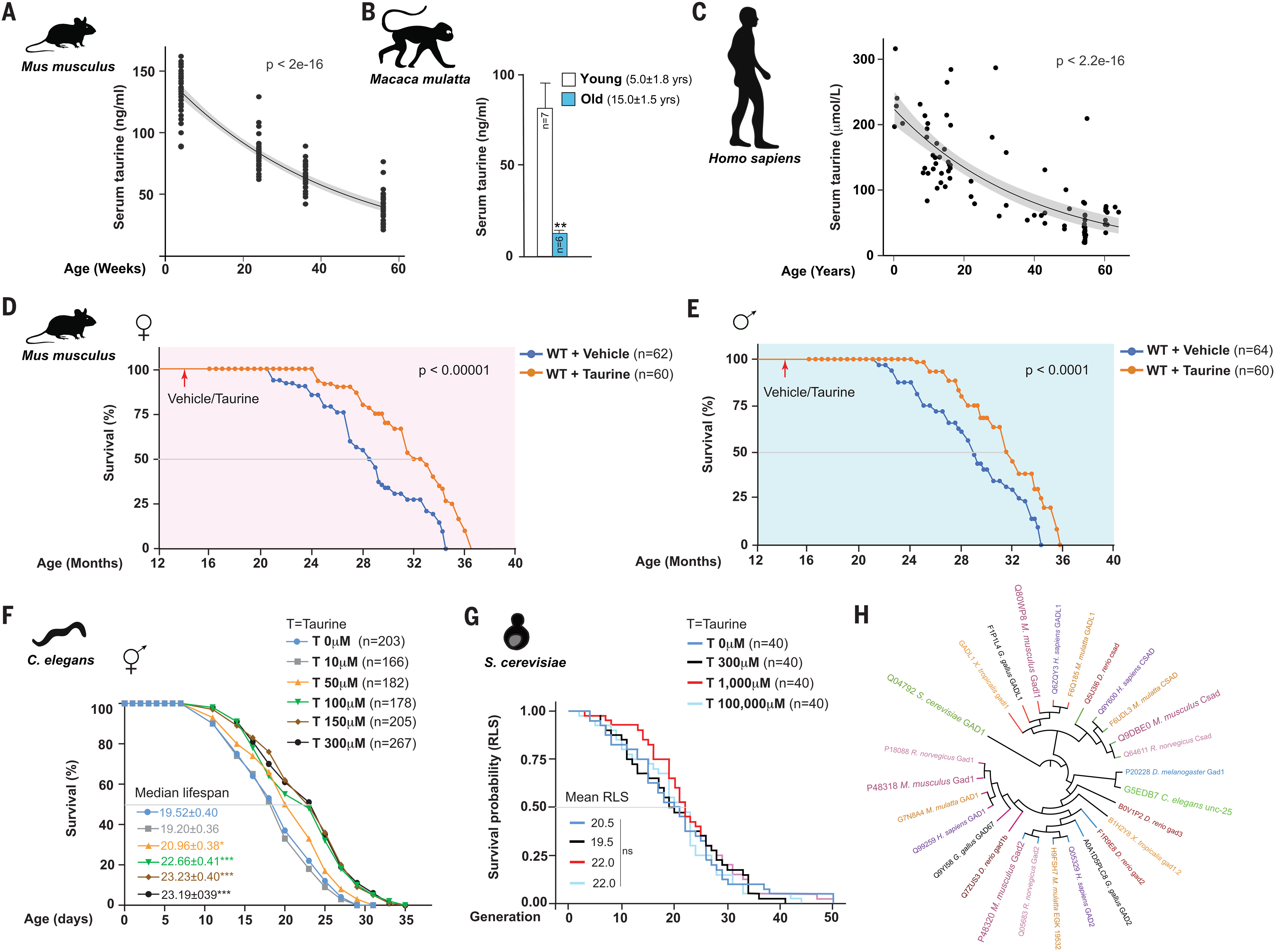
Fig. 1. La carence en taurine est un moteur du vieillissement des espèces évolutives divergentes.
(A à C) Niveaux de taurine sérique chez les souris femelles à différents âges ( A ), chez les jeunes ( 5 ans ) et les vieux ( 15 ans ) singes femelles ( B ), et chez l’homme à différents âges ( C ). Dans ( A ) et ( C ), les régions ombrées indiquent une erreur standard. (D et E) Dosage à vie d’âge moyen ( 14 mois ) WT femelle ( D ) et mâle ( E ) C57Bl / 6J souris nourries oralement de taurine ( 1000 mg par kg de poids corporel par jour ) à 10h00 jusqu’à la fin de la vie. (F) Essai de durée de vie des nématodes WT qui ont été nourris avec un régime complété par différentes concentrations de taurine ( 0, 10, 50, 100, 150 et 300 μM ). (G) Dosage RLS dans la levure cultivée sur des plaques YPD avec différentes concentrations de taurine ( 0, 300, 1000 et 100 000 μM ). (H) Analyse phylogénétique des enzymes de biosynthèse de la taurine chez les eucaryotes. Les détails de l’analyse statistique sont les suivants: Le logiciel OASIS (https://sbi.postech.ac.kr/oasis) a été utilisé pour calculer p valeurs utilisant un test de log rank ( la méthode Mantel-Cox ) dans les expériences de souris et de vers, et un test de Wilcoxon rank-sum a été utilisé pour calculer p valeurs dans les tests RLS de levure. N les valeurs sont affichées dans les panneaux. Toutes les valeurs sont des moyennes ± SEM. ns indique non significatif. ***p ≤ 0,001, **p ≤ 0,01 et *p ≤ 0,05 * sont contre WT ou contrôle.
La supplémentation en taurine augmente la durée de vie des souris
Pour déterminer si la baisse observée de la concentration de taurine contribue au vieillissement, nous avons administré oralement une solution témoin ou de la taurine à 1000 mg par kg de poids corporel ( T1000 ), une fois par jour à 10h00, à 14 mois ( âge moyen ) C57Bl / 6J WT souris femelles et mâles jusqu’à la fin de la vie. La dose et la fréquence d’administration de taurine ont été sélectionnées sur la base d’une étude pilote qui a montré que lorsqu’elles étaient administrées une fois par jour à des souris d’âge moyen, ce régime a augmenté les concentrations maximales de taurine sanguine aux concentrations de base chez les jeunes souris ( 4 semaines ) ( voir les matériaux et les méthodes et les figues. S1, A à D, pour une description de ces études ). Quel que soit leur sexe, les souris nourries à la taurine ont survécu plus longtemps que les souris témoins (Fig. 1, D et E). L’augmentation médiane de la durée de vie était de 10 à 12% et l’espérance de vie à 28 mois a augmenté de 18 à 25% (Fig. 1, D et E). Les estimations médianes de la durée de vie des souris femelles et mâles témoins étaient cohérentes dans deux cohortes indépendantes ( femelles: 871 à 885 jours; mâles: 785 à 815 jours ). Dans ces expériences, les souris témoins et nourries à la taurine avaient accès ad libitum au même chow ( Teklad irradié 18% de protéines et 6% de matières grasses -2918 ). Ainsi, l’amélioration de la survie des souris nourries à la taurine n’était pas une conséquence d’une faible survie des animaux témoins ou de différences de régime alimentaire. Collectivement, ces résultats indiquent que la carence en taurine est un moteur du vieillissement chez la souris car son inversion augmente la durée de vie.
La supplémentation en taurine augmente la durée de vie des vers mais pas de la levure
La voie de biosynthèse de la taurine est conservée évolutivement chez les eucaryotes multicellulaires (21, 36). Pour savoir si la taurine affecte également le vieillissement chez des espèces autres que les souris, nous avons mené des expériences de supplémentation en taurine chez des espèces inférieures. Tout d’abord, nous avons testé l’effet de la taurine dans les vers, qui présentent également une baisse associée à l’âge de la taurine (37). La supplémentation en taurine a considérablement prolongé la durée de vie médiane et maximale de Caenorhabditis elegans d’une manière dose-dépendante (Fig. 1F). La longévité, calculée en utilisant la durée de vie médiane des vers non traités et traités à la taurine, a été étendue de 10 à 23% dans les vers traités avec des concentrations plus élevées de taurine dans quatre cohortes de vers indépendantes et dans deux laboratoires indépendants ( Université de Washington, Seattle, WA, États-Unis, et le National Institute of Immunology, New Delhi, Inde ) (Fig. 1F et fig. S1, E à G ). Nous avons également étudié l’effet de la taurine sur la durée de vie réplicative ( RLS ) dans la levure en herbe, Saccharomyces cerevisiae, qui est un eucaryote unicellulaire. Contrairement aux souris et aux vers, la supplémentation en taurine n’a pas affecté le RLS (38) de levure cultivée sur des plaques de levure riches en nutriments – peptone – dextrose ( YPD ) ou sur un milieu synthétique (Fig. 1G et fig. S1, H à J ). Ces résultats peuvent s’expliquer par des différences organisationnelles dans le métabolisme de la taurine. Par exemple, les enzymes du métabolisme de la taurine levure glutamate décarboxylase ( GAD ) et le CSAD de mammifère ont divergé tôt au cours de l’évolution (Fig. 1H) (39). Ainsi, bien que la taurine ne puisse pas affecter le RLS chez les eucaryotes unicellulaires, son effet sur la durée de vie est conservé chez les invertébrés et les mammifères.
La supplémentation en taurine augmente la durée de santé des souris femelles WT âgées
Une thérapie anti-âge significative devrait améliorer la durée de vie ou la période de vie saine (2–5, 40). Évaluer les effets de la supplémentation en taurine sur la durée de vie, nous avons administré par voie orale de la taurine à 500 ( T500 ) et 1000 ( T1000 ) mg par kg de poids corporel par jour aux souris femelles une fois par jour pendant 10 à 12 mois, à partir de l’âge de 14 mois, et a analysé la santé des os, des muscles, du cerveau, du pancréas, des graisses, des intestins, et le système immunitaire à travers des tests fonctionnels ou une analyse tissulaire des animaux décédés ( fig. S2A ).
Gain de poids corporel associé à l’âge réduit et masse osseuse améliorée chez les souris femelles traitées avec de la taurine
Le traitement par la taurine a supprimé le gain de poids corporel associé à l’âge de ~ 10% dans le groupe T1000 par rapport aux témoins (Fig. 2A). Le poids des graisses divisé par le pourcentage de poids corporel a été réduit en fonction de la dose chez les souris traitées à la taurine (Fig. 2B). Les souris administrées par la taurine ne différaient pas par la longueur corporelle et la consommation alimentaire ( chez les souris à poids stable ) ou souffraient d’effets toxiques évidents ( comme en témoigne un score histopathologique aveuglé des sections tissulaires par un histopathologiste ) dans plusieurs tissus par rapport aux témoins ( fig. S2, B à D ). L’analyse de la structure osseuse par histologie et tomodensitométrie ( μCT ) a montré que le traitement à la taurine augmentait la masse osseuse ( volume osseux divisé par le pourcentage de volume total ) dans la colonne vertébrale et le fémur par rapport à celui de contrôles (Fig. 2C). Un test de flexion en trois points a montré que la charge et la rigidité maximales du fémur — deux substituts de la qualité osseuse — s’amélioraient chez les souris traitées à la taurine par rapport aux témoins (Fig. 2D). La taurine a également guéri l’ostéoporose et supprimé le gain de poids corporel induit par l’ovariectomie dans un modèle de rongeur de ménopause ( fig. S2, E à G ). Ces dernières preuves indiquent que l’effet de la taurine sur les paramètres de santé chez les femmes pourrait être lié à son effet sur le poids corporel dans d’autres conditions de vieillissement, telles que la ménopause.
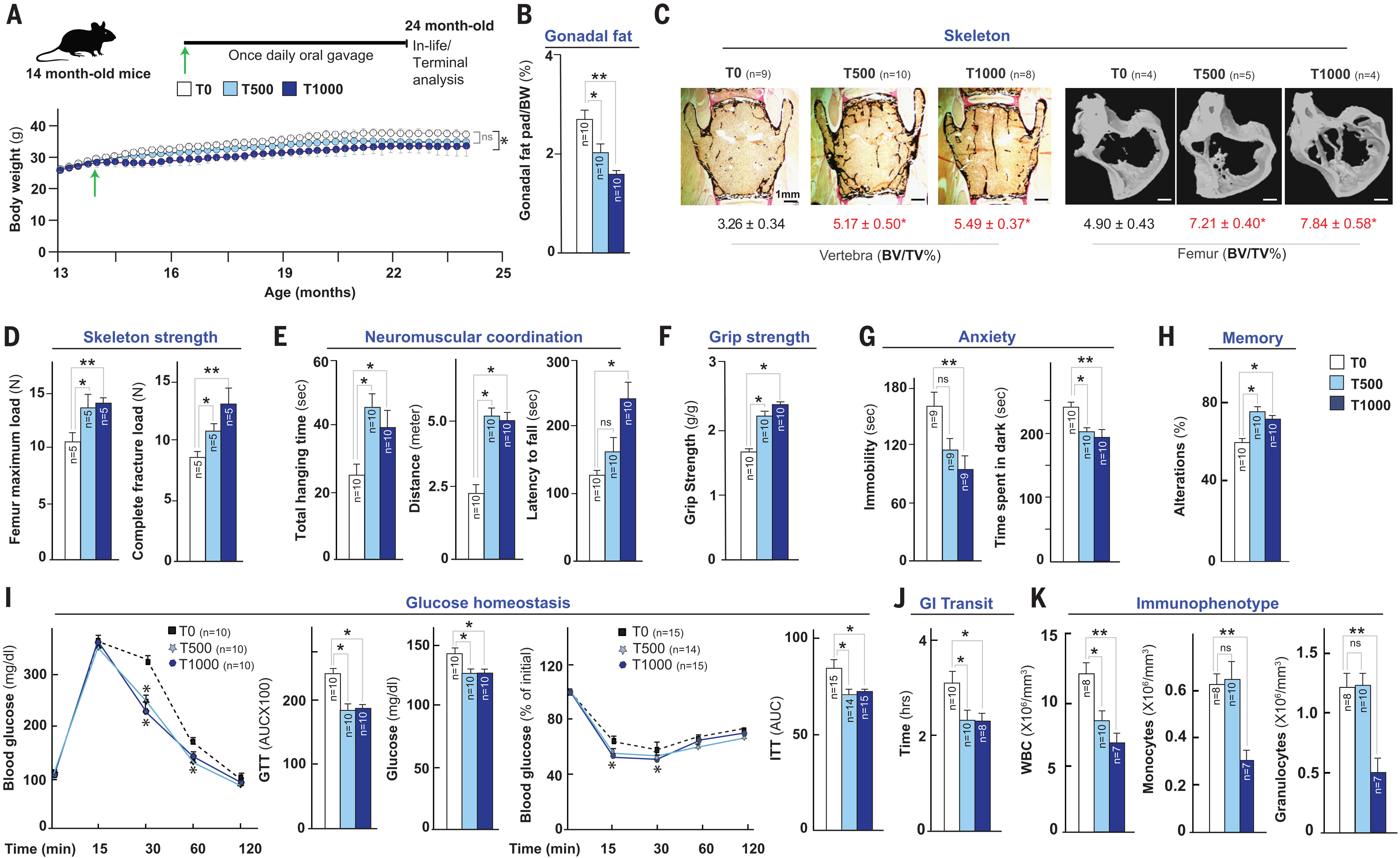
Fig. 2. La supplémentation en taurine augmente la durée de santé des souris âgées.
(A à K) Changements de poids corporel ( A ), pourcentage de graisse ( B ), structure osseuse, paramètres de résistance dans la colonne vertébrale et le fémur [ ( C ) et ( D ) ], force neuromusculaire et musculaire [ ( E ) et ( F ) ] ( rotarode, suspension de fil et tests de résistance à l’adhérence ), anxiété ( G ) suspension de queue et tests de lumière noire (, mémoire ( H ) ( Y test de labyrinthe ), fonction pancréatique ( I ) ( tests de tolérance au glucose et à l’insuline ), transit GI ( J ) (, et immunophénotypage ( K ) ( paramètres cellulaires immuns dans le sang ) chez les WT de 24 mois C57Bl / 6J souris femelles nourries oralement une fois par jour avec de la taurine ( 0, 500 ou 1000 mg par kg de poids corporel par jour ) à partir de l’âge moyen ( 14 mois ). Dans ( C ), les images histologiques ( gauche ) et μCT ( droite ) sont affichées. Une analyse statistique a été réalisée à l’aide de Graph Pad Prism 7. Les données ont été considérées comme statistiquement significatives à p ≤ 0,05 calculé en utilisant Student’s t test, analyse unidirectionnelle de la variance ( ANOVA ), ou ANOVA bidirectionnelle. n les valeurs sont affichées dans les panneaux. Toutes les valeurs sont des moyennes ± SEM. ns indique non significatif. **p ≤ 0,01 et *p ≤ 0,05 sont contre WT ou contrôle. BV, volume osseux; BW, poids corporel; GTT, test de tolérance au glucose; ITT, test de tolérance à l’insuline; TV, volume total.
Augmentation de l’endurance, de la coordination et de la force des souris femelles traitées à la taurine
Une analyse de l’effet du traitement à la taurine sur les fonctions neuromusculaires a montré que le temps de suspension total et la distance parcourue dans le test du rotarod ont été augmentés dans les groupes T500 et T1000, tandis que la latence à tomber dans le test de suspension de fil a été augmentée dans le groupe T1000 (Fig. 2E). Les tests de résistance à la poignée ont révélé que les deux doses de taurine augmentaient la force musculaire par rapport aux témoins (Fig. 2F).
Comportement et anxiété de type dépression réduits et comportement et mémoire exploratoires améliorés chez les souris femelles traitées à la taurine
L’anxiété accrue et la diminution de l’exploration sont des changements de comportement induits par l’âge (41). Dans l’essai de suspension de queue (42), les souris traitées à la taurine ont montré un comportement moins dépressif par rapport aux témoins (Fig. 2G). Le test de la boîte sombre-lumière (43) a révélé que les souris traitées à la taurine passaient moins de temps dans la zone sombre, ce qui indique une moindre anxiété (Fig. 2G). Le test du labyrinthe Y (44) a montré que les souris traitées à la taurine avaient une curiosité naturelle plus élevée pour l’exploration par rapport aux souris témoins (Fig. 2H).
Homéostasie améliorée du glucose et temps de transit gastro-intestinal chez les souris femelles traitées à la taurine
L’analyse de l’homéostasie du glucose à l’aide d’un test de tolérance au glucose intrapéritonéal a montré que les souris traitées à la taurine métabolisaient le glucose oral plus efficacement que les souris témoins et avaient des concentrations de glucose plus faibles lorsqu’elles étaient nourries ad libitum (Fig. 2I). De même, les souris traitées à la taurine avaient amélioré la sensibilité à l’insuline dans le test de tolérance à l’insuline (Fig. 2I). Ces améliorations de l’homéostasie du glucose pourraient être une conséquence de l’adiposité réduite chez les souris traitées à la taurine. Le temps de transit gastro-intestinal ( GI ) augmente avec l’âge (45). Une analyse du temps de transit intestinal à l’aide d’un colorant carmin rouge non absorbable administré par gavage oral (46) a montré un transit plus rapide chez les souris traitées à la taurine, ce qui pourrait contribuer à la perte de poids observée chez ces souris (Fig. 2J).
Hauteur myéloïde-leucocytaire améliorée chez les souris femelles âgées traitées à la taurine
Le vieillissement modifie le nombre de cellules immunitaires dans le sang, ce qui entraîne une sensibilité accrue à l’infection (47). Une numération formule sanguine complète a montré que le traitement par la taurine diminuait le nombre de globules blancs ( WBC ), de monocytes et de granulocytes mais pas le nombre de globules rouges (Fig. 2K et fig. S2H ). Bien qu’il n’y ait pas de différence dans l’efficacité des doses de T500 et T1000 sur les nombres de WBC, le nombre de monocytes et de granulocytes n’a diminué qu’à la dose de T1000 (Fig. 2K). Ces résultats montrent que la proéminence myéloïde-leucocytaire associée aux états inflammatoires liés au vieillissement est améliorée par le traitement à la taurine à haute dose.
Amélioration des mesures de la portée de la santé chez les souris WT mâles d’âge moyen après administration de taurine
Évaluer si la taurine affecte la durée de santé des souris mâles, comme elle le fait chez les souris femelles, nous avons traité des souris mâles WT de 14 mois avec ou sans T1000 pendant 8 à 16 semaines et avons mesuré la graisse, les os, les muscles, le pancréas et la santé du cerveau ( fig. S3A ). La taurine n’a pas affecté la prise de poids corporel chez les hommes jusqu’à 16 semaines, mais a considérablement réduit le poids des graisses divisé par le pourcentage de poids corporel par rapport aux témoins ( fig. S3, B et C ). Pour identifier la cause de l’adiposité réduite des souris traitées à la taurine, nous avons analysé les dépenses énergétiques. Les souris traitées à la taurine ont consommé plus d’oxygène, généré plus de dioxyde de carbone et ont eu des taux d’échange respiratoire et des dépenses énergétiques plus élevés même si leur activité totale a diminué par rapport à celle des témoins ( fig. S3, D à H ). Les souris mâles traitées à la taurine ont également montré une plus grande force musculaire, une coordination neuromusculaire,densité osseuse, tolérance au glucose et mémoire ainsi que réduction de l’anxiété par rapport aux témoins ( fig. S3, I à N ). Ainsi, la supplémentation en taurine a amélioré la fonction de chaque organe étudié chez les souris femelles et mâles d’âge moyen et a probablement augmenté la durée de santé globale.
Effets de la taurine sur les mécanismes cellulaires pour augmenter la durée de vie saine
Quels sont les mécanismes par lesquels la taurine affecte les fonctions cellulaires pour augmenter la durée de vie saine? Pour répondre à cette question, nous avons effectué une analyse de séquençage d’ARN ( ARN-seq ) dans des ostéoblastes déficients en taurine et témoins de souris. Ces cellules formant des os ont été choisies car elles expriment abondamment un transporteur de taurine ( encodé par Slc6a6), dont la suppression altère la différenciation et la fonction des cellules mutantes en culture et chez la souris ( fig. S4, A à E ). Inversement, le nombre et la fonction des ostéoblastes de l’ET ont été augmentés par traitement à la taurine in vitro et in vivo. ( fig. S4, A à E ). Analyse ARN-seq (48) des ostéoblastes déficients en taurine ont montré que les principales fonctions biologiques identifiées dans l’analyse d’enrichissement de l’ensemble génétique ( GSEA ) sont liées aux mécanismes de vieillissement (13) tel que la fonction télomère, le stress oxydatif, la fonction du système immunitaire, la traduction des protéines et le maintien des cellules souches (Fig. 3A et figues. S4, F à M ). Une recherche du terme “ vieillissement ” dans la sortie des voies GSEA a montré des altérations importantes dans six signatures de gènes ( voir le tableau S1 pour plus de détails ). Les six signatures ont montré la direction attendue du changement ( régulation ascendante ou descendante ) pour un effet pro-âge ( fig. S4N ). Ensemble, ces résultats impliquent que la carence en taurine génère une signature transcriptomique liée au vieillissement dans les cellules.
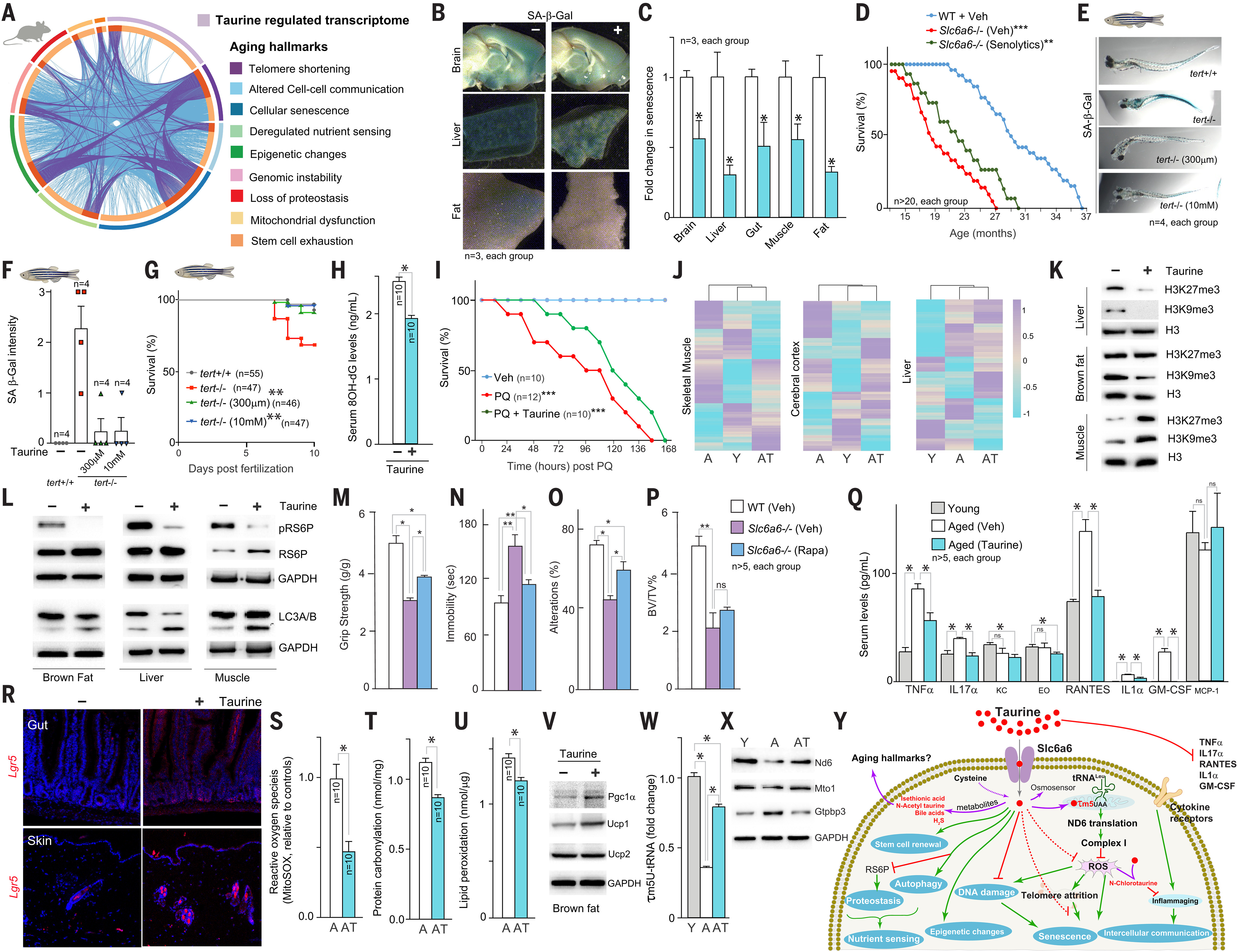
Fig. 3. La régulation de la durée de vie saine par la taurine est associée à des modifications des caractéristiques de vieillissement multiple.
(A) Tracé de cirques représentant une analyse comparative d’un transcriptome déficient en taurine avec les signatures génétiques centrales de neuf caractéristiques de vieillissement. (B et C) coloration SA β-Gal ( cellules colorées au bleu ) ( B ) et quantification relative de la coloration ( C ) dans les tissus collectés auprès de souris avec ou sans supplémentation en taurine, comme vu avec imagerie de montage entier. (D) Dosage de la durée de vie du déficient congénital en taurine (Slc6a6− / −) souris et témoins littermates qui ont reçu soit un véhicule, soit des sénolytiques ( D + Q traitement ) toutes les deux semaines jusqu’à la fin de la vie. (E à G) Photomicrographes à coloration SA β-Gal ( E ), quantification relative de la coloration ( F ) et analyse de survie ( G ) de déficient en télomérase [tert− / −( G2 ) ] embryons de poisson zèbre avec ou sans supplémentation en taurine ( 300 μm ou 10 mM ) à partir de 2 dpf. (H) Concentrations sériques de 8-OH-dG chez les souris traitées par véhicule ( − ou traitées à la taurine ) ( +. (je) Courbes de survie de Kaplan-Meier pour les souris après traitement paraquat ( PQ ), avec ou sans supplémentation préalable en taurine ( T1000 pendant 1 mois ). Veh, véhicule. (J et K) Niveaux comparatifs de méthylation de l’ADN des sites de CpG liés à l’âge de 2045 dans le muscle, le cortex cérébral et le foie ( J ) et modifications des taux d’histone H3K27me3, H3K9me3 et H3 dans le foie, graisse brune et muscle ( K ) de 4 mois WT ( jeune, Y ), WT (, 16 mois, traité par véhicule, âgé de 16 mois, A ) et 16 mois -WT ( taurine, vieux, AT ) souris. (L) Changements dans la protéine S6 phosphoribosomale ( pRS6P ) et les taux de LC3A / B dans la graisse brune, le foie et les muscles des souris âgées traitées par véhicule ou taurine. GAPDH, glycéraldéhyde phosphate déshydrogénase. (M à P) Changements dans la fonction musculaire ( test de résistance à la poignée ) ( M ), anxiété ( test de suspension à queue ) ( N ), mémoire ( Y test de labyrinthe ) (, et masse osseuse [ volume osseux divisé par le pourcentage volumique total ( BV / TV% ) ] ( P ) chez les 6 mois Slc6a6− / − souris et commandes littermates ayant reçu soit un véhicule, soit de la rapamycine ( une fois par jour pendant 6 semaines ). (Q) Niveaux sériques de diverses cytokines chez les jeunes souris, les souris âgées et les souris âgées traitées à la taurine. EO, éotaxine; KC, cytokine kératinocytaire. (R à V) Analyse d’hybridation in situ de Lgr5 expression dans l’intestin et la peau ( R ), niveaux de ROS mitochondriaux ( radicaux anion superoxyde, test MitoSOX ) dans les mitochondries musculaires squelettiques ( S ), taux de protéines carbonyle dans le foie ( T ), niveaux de peroxydation lipidique dans le foie ( U ) et Pgc1α, Ucp1 et Ucp2 dans la graisse brune ( V ) des souris âgées traitées sans ou avec de la taurine. (W et X) Modifications des taux de protéines τm5U tRNA ( W ) et Nd6, Mto1 et Gtpbp3 dans le foie ( X ) des jeunes souris, des souris âgées et des souris âgées traitées avec de la taurine. Dans ( W ), n ≥ 6 souris dans chaque groupe. (Y) Représentation schématique de l’effet des biomolécules dérivées de la taurine et de la taurine ( en rouge ) sur les caractéristiques classiques du vieillissement. Pour ( K ), ( L ), ( V ) et ( X ), les Western blots sont représentatifs d’au moins trois répétitions biologiques indépendantes. Les détails de l’analyse statistique sont les suivants: Pour ( D ), ( G ) et ( I ), le logiciel OASIS (https://sbi.postech.ac.kr/oasis) a été utilisé pour calculer p valeurs utilisant un test de log rank ( la méthode Mantel-Cox ), et pour d’autres panneaux, une analyse statistique a été effectuée avec Graph Pad Prism 7 en utilisant Student’s t test ou ANOVA unidirectionnelle ou bidirectionnelle. Toutes les valeurs sont des moyennes ± SEM. ns indique non significatif. ***p ≤ 0,001, **p ≤ 0,01 et *p ≤ 0,05 sont contre WT ou contrôle.
Suppression de la sénescence par la taurine
Une analyse en réseau des gènes régulés par la taurine a montré que les gènes du phénotype sécrétoire associé à la sénescence ( SASP ), tels que p16 et p21, qui encodent les inhibiteurs des kinases dépendantes de la cycline et favorisent l’arrêt du cycle cellulaire, a formé le plus grand nombre d’interactions génétiques ( fig. S4O ). Conformément à l’idée que la taurine supprime la sénescence, l’augmentation induite par l’irradiation de la β-galactosidase associée à la sénescence ( SΑ β-gal ) la coloration dans les ostéoblastes cultivés avec de la taurine était d’environ un quart de celle dans les cellules cultivées sans taurine ( fig. S4P ). Dans les expériences de culture neuronale, la supplémentation en taurine a augmenté la survie neuronale après le traitement paraquat, un agent nuisible à l’ADN qui induit une sénescence (49) ( fig. S4Q ). De plus, la supplémentation en taurine a diminué une augmentation associée à l’âge de la sénescence chez la souris (Fig. 3, B et C, et fig. S5A ). Pour tester si la carence en taurine provoque l’accumulation de cellules sénescentes, nous avons utilisé des souris dépourvues de transporteur de taurine Slc6a6 (23). Le manque de Slc6a6 compromet l’entrée de la taurine dans les cellules embryonnaires, rendant les embryons déficients en taurine. Les phénotypes observés postnatalement chez les 0,5 à 3 mois Slc6a6 souris mutantes (23) pourrait être dû à une carence en taurine affectant ces phénotypes pendant le développement ou postnatalement ( ci-après, nous appelons ces souris des souris congénitales déficientes en taurine ). Adulte Slc6a6− / − les souris ont montré des phénotypes accélérés liés au vieillissement, y compris une diminution de la densité osseuse, une mauvaise coordination neuromusculaire, une force musculaire compromise, une anxiété accrue et une diminution de la mémoire ( fig. S5, C à L ). L’analyse des os, des muscles, du cerveau, des graisses et du foie a montré une augmentation de la sénescence chez les souris déficientes en taurine par rapport aux témoins ( fig. S5, A et B ). Pour déterminer si l’accumulation de cellules sénescentes dans ces organes contribue à la durée de santé compromise des souris déficientes en taurine, nous avons traité l’enfant de 8 mois Slc6a6− / − souris avec ou sans combinaison de sénolytiques — dasatinib ( D ) (50) et quercétine ( Q ) ( D + Traitement Q ) — bimensuel pendant 4 mois. Par rapport aux commandes, D + T-traité Q Slc6a6− / − les souris avaient une plus faible abondance de marqueurs SASP ( fig. S5M ). Le traitement D + Q a également amélioré les paramètres liés aux os, aux muscles, à l’anxiété et à la mémoire Slc6a6− / − souris ( fig. S5, N à Q ). Les souris déficientes en taurine avaient une durée de vie plus courte que les souris WT, et la durée de vie médiane des souris mutantes qui ont reçu un traitement sénolytique jusqu’à la fin de la vie a augmenté de ~ 21% (Fig. 3D). La constatation selon laquelle le traitement sénolytique n’a pas sauvé la durée de vie plus courte des souris déficientes en taurine suggère que la taurine affecte également d’autres facteurs que la sénescence. Nous avons donc évalué les caractéristiques moléculaires et cellulaires d’autres caractéristiques de vieillissement chez les souris d’âge moyen supplantées par la taurine et chez les souris déficientes en taurine.
Taurine supprime les conséquences néfastes d’une carence en télomérase
Le raccourcissement par télomère basé sur la réplication déclenche la sénescence cellulaire et affecte le vieillissement (51). La supplémentation en taurine chez la souris ou le poisson zèbre ou sa carence chez la souris n’a pas affecté l’expression du gène de la télomérase ( fig. S5, R et S ). Pour déterminer si la taurine affecte une carence en télomérase – détérioration induite de la santé de l’organisme, nous avons utilisé un modèle de poisson zèbre de carence en télomérase (52). tert− / −( G2 ) les poissons présentent une augmentation de la sénescence et ~ 40% d’entre eux meurent dans les 10 jours suivant la fertilisation ( dpf ) (52). Complément du support utilisé pour tert− / −( G2 ) poisson avec taurine, à partir de 2 dpf, sénescence supprimée (Fig. 3, E et F). De plus, à des concentrations de 300 μM et 10 mM, la taurine a sauvé la létalité tert− / −( G2 ) embryons de poisson zèbre (Fig. 3G).
La taurine supprime les dommages à l’ADN et améliore la survie des souris après les dommages à l’ADN oxydatif
Le vieillissement est associé à des lésions d’ADN génomique dans plusieurs types de cellules (53). La supplémentation en taurine a réduit l’abondance sérique de 8-hydroxydésoxyguanosine ( 8-OH-dG ), une mesure des dommages oxydants à l’ADN (54), chez les souris âgées (Fig. 3H). Inversement, les dommages à l’ADN [ mesurés comme l’abondance du membre de la famille des histones phospho-γ-H2A X ( H2Ax ) ] ont été augmentés dans le muscle des souris déficientes en taurine ( fig. S5T ). Dans un modèle paraquat de dommages à l’ADN – létalité induite, les souris administrées avec du paraquat sans supplémentation préalable en taurine sont décédées dans les 150 heures, mais les souris traitées avec de la taurine ont vécu légèrement plus longtemps (Fig. 3I). Ainsi, la supplémentation en taurine a supprimé les dommages à l’ADN et amélioré la survie des souris après les dommages à l’ADN oxydatif.
La taurine affecte les changements épigénétiques du génome
La méthylation aux sites CpG et des histones change avec l’âge et affecte l’état de la chromatine, qui affecte l’emballage ADN et l’expression génique (55, 56). Nous avons donc analysé les changements dans la méthylation des sites de 2045 CpG et mesuré deux modifications d’histone [ histone 3 lysine 9 triméthylation ( H3K9me3 ) et histone 3 lysine 27 triméthylation ( H3K27me3 ) obtenu dans plusieurs tissus de souris d’âge moyen non traitées ou traitées à la taurine et les a comparées à celles des tissus de jeunes souris. L’analyse de regroupement a montré que le schéma de méthylation du CpG dans le muscle et le cortex cérébral des vieilles souris traitées à la taurine était plus similaire à celui des jeunes souris qu’à celui des vieilles souris non traitées (Fig. 3J). Cependant, le schéma hépatique des souris supplantées par la taurine était plus similaire à celui des souris âgées que celui des jeunes souris (Fig. 3J). À l’inverse, les muscles des souris déficientes en taurine ont montré des changements dans la quantité de méthylation du site CpG, et le schéma de méthylation de l’ADN des muscles chez les souris déficientes en taurine de 70 semaines était similaire à celui des souris WT de 206 semaines ( fig. S5U ). Le traitement par la taurine a diminué l’abondance de H3K9me3 dans la graisse brune et le foie, mais l’a augmentée dans le muscle squelettique; L’abondance de H3K27me3 a été supprimée dans le foie, augmentée dans les muscles et non affectée dans la graisse brune (Fig. 3K). Les changements variés dans l’ADN et la méthylation de l’histone indiquent que la taurine peut affecter la conformation de la chromatine, ce qui pourrait contribuer à une transcription modifiée pendant le vieillissement.
Taurine module les voies de détection et de protéostase des nutriments
Les cellules vieillissantes ont une capacité réduite à détecter les nutriments et à maintenir la protéostase (57). Nous avons évalué les changements dans la détection des nutriments en mesurant la phosphorylation de la protéine S6 ribosomale ( RS6P ), un régulateur clé de la fonction ribosomale, et protéostase en mesurant les changements du rapport d’abondance des isoformes A et B de la chaîne lumineuse 3 ( LC3A / B ), un marqueur d’autophagie. La supplémentation en taurine a diminué la phosphorylation du RS6P dans le foie, la graisse brune et le muscle squelettique (Fig. 3L). La phosphorylation de RS6P a été augmentée dans le muscle des souris déficientes en taurine ( fig. S5V ). Les souris supplantées par la taurine avaient plus d’autophagie ( selon l’abondance de LC3A / B ) dans le foie, la graisse brune et le muscle squelettique, alors qu’il diminuait chez les souris déficientes en taurine (Fig. 3L et fig. S5V ). Pour tester si une augmentation de la phosphorylation du RS6P et une diminution de l’autophagie contribuent à la durée de santé compromise chez les souris déficientes en taurine, nous avons traité Slc6a6− / − souris avec ou sans rapamycine [ 8 mg par kg de poids corporel par voie intrapéritonéale une fois par jour (58) pendant 6 semaines ], ce qui inhibe la phosphorylation du RS6P et augmente l’autophagie. Par rapport aux souris témoins, les souris déficientes en taurine traitées à la rapamycine ont montré des paramètres améliorés liés aux muscles, à l’anxiété et à la mémoire, mais pas une masse osseuse accrue (Fig. 3, M à P). Ainsi, les effets de la supplémentation en taurine sur la détection des nutriments et les voies de protéostase contribuent à ses effets bénéfiques sur plusieurs paramètres de santé.
Effets de la taurine sur les cytokines inflammatoires
La communication intercellulaire est compromise avec l’âge (59). Un exemple est l’accumulation de proinflammatoires et d’autres cytokines (59). Concentrations sériques de facteur de nécrose tumorale – α ( TNFα ), interleukine-17α ( IL-17α ), RANTES ( régulées lors de l’activation, cellule T normale exprimée et vraisemblablement sécrétée ), IL- 1α, et le facteur de stimulation des colonies de macrophages granulocytes ( GM-CSF ) a été augmenté chez les souris d’âge moyen par rapport aux jeunes souris, mais les souris d’âge moyen traitées à la taurine avaient des quantités de ces cytokines similaires à celles des jeunes animaux témoins (Fig. 3Q). Ces résultats, ainsi que l’observation selon laquelle le rapport des cellules myéloïdes aux cellules lymphoïdes a été significativement diminué chez les souris supplémentées en taurine (Fig. 2K), indique que des concentrations soutenues de taurine aident à prévenir l’état pro-inflammatoire observé pendant le vieillissement.
Effets positifs de la taurine sur la santé des cellules souches ou leur renouvellement
Le vieillissement réduit la capacité des tissus à se régénérer après une blessure. Ceci est lié à des défauts dans les cellules souches spécifiques aux tissus (60). Nous avons analysé les changements dans le nombre de populations de cellules souches dans l’épithélium intestinal et les follicules pileux obtenus à partir de souris d’âge moyen non traitées et traitées à la taurine par coloration pour le gène codant pour la répétition riche en leucine –contenant de la protéine G – récepteur couplé 5 (Lgr5), qui est un site d’intégration sans ailes ( Wnt ) gène cible exprimé dans la tige ou les cellules progénitrices (61). Les nombres de Lgr5+ les cellules de ces deux tissus ont été augmentées par supplémentation en taurine (Fig. 3R). Inversement, le nombre de Lgr5+les cellules de l’épithélium intestinal et les follicules pileux ont diminué chez les souris déficientes en taurine par rapport aux souris témoins ( fig. S5W ). Ainsi, la supplémentation en taurine peut augmenter la capacité de régénération de certains tissus en augmentant le nombre de cellules souches résidentes.
Promotion de la taurine de la santé mitochondriale
La biogenèse mitochondriale compromise et la capacité oxydative conduisent à une accumulation progressive d’espèces réactives de l’oxygène ( ROS ) – dommages médiés qui contribuent au vieillissement (62). L’accumulation de ROS dans les mitochondries isolées du muscle des souris d’âge moyen traitées à la taurine a diminué par rapport à celle du muscle des souris témoins (Fig. 3S), alors qu’il a été augmenté dans le muscle des souris déficientes en taurine ( fig. S6A ). La mesure de la peroxydation lipidique et de la carbonylation des protéines, deux marqueurs indirects des dommages moléculaires induits par le ROS, dans le foie a montré une diminution ( de ~ 22 et ~ 11%, respectivement ) chez les souris supplémentées en taurine par rapport aux souris témoins (Fig. 3, T et U). Évaluation de l’abondance du proliférateur peroxysomique – récepteur activé – coactivateur gamma 1 alpha ( Pgc1α ), régulateur clé de la biogenèse mitochondriale, et protéine de découplage 1 ( Ucp1 ), qui dissocie l’oxydation du carburant mitochondrial et la respiration de l’adénosine triphosphate ( ATP ) production (63), chez les graisses brunes, a montré des quantités accrues chez les souris d’âge moyen traitées à la taurine, et leur abondance a diminué chez les souris déficientes en taurine (Fig. 3V et fig. S6B ). Ces résultats indiquent que la promotion de la taurine de l’homéostasie mitochondriale peut contribuer à son effet sur la santé.
Nous avons ensuite étudié comment la taurine affecte les mécanismes cellulaires pendant le vieillissement (24). Un pool de taurine cytosolique est activement transporté dans les mitochondries, où il est conjugué aux résidus d’uridine à la position oscillante de l’ARNtLeu( UUA ), formant 5-taurinométhyluridine-ARNtLeu( UUA ) ( τm5U-tRNA ) (64). La modification de τm5U est spécifique aux ARNt mitochondriaux (64) et favorise la traduction de la protéine NADH-ubiquinone oxydoréductase 6 ( ND6 ), une sous-unité I du complexe de chaîne de transport d’électrons (64). Nous avons donc mesuré si la modification de l’ARNt τm5U a changé pendant le vieillissement chez la souris. La teneur en τm5U des ARNt a été réduite de > 60% dans le foie vieilli par rapport au foie jeune; chez les souris supplantées par la taurine, la teneur en τm5U des ARNt n’a été réduite que d’environ 20% (Fig. 3W et fig. S6C ). Conforme au rôle de τm5U-tRNALeu dans la promotion de la traduction de ND6, les quantités de cette protéine ont diminué chez les souris âgées par rapport aux jeunes souris et ont été augmentées par supplémentation en taurine (Fig. 3X et fig. S6D ). La supplémentation en taurine, cependant, n’a pas affecté la traduction de l’ADN nucléaire – phosphorylation oxydante mitochondriale codée ( OXPHOS ) protéines chez les souris âgées ( fig. S6E ). Nous avons mené des expériences sur les vers pour vérifier si la régulation de la santé des organismes par la taurine nécessite une activité complexe. La taurine a augmenté la motilité des vers témoins, ce qui indique un meilleur état de santé (65), mais n’a pas réussi à le faire dans des vers traités à la roténone ( fig. S6F ), suggérant que l’augmentation de l’activité du complexe mitochondrial I est un mécanisme par lequel la taurine favorise la santé. Les analyses susmentionnées des caractéristiques moléculaires et cellulaires des caractéristiques de vieillissement montrent que pendant le vieillissement, la supplémentation en taurine peut conférer des avantages pour la santé en affectant ces caractéristiques dans diverses cellules ou tissus (Fig. 3Y).
La taurine à circulation plus faible et ses métabolites chez l’homme sont associés à de multiples pathologies associées à l’âge
Déterminer si les taux sanguins de métabolites de la voie taurine ( taurine, hypotaurine et N-acétyltaurine ) sont associés à des variables de santé chez l’homme, nous avons effectué une analyse d’association des niveaux de métabolites de la taurine en circulation avec > 50 facteurs de risque cliniques chez 11 966 sujets de l’étude EPIC-Norfolk ( fig. S7, A et B ) (66). Nous avons constaté que des niveaux plus élevés de taurine sanguine et d’hypotaurine étaient associés à un indice de masse corporelle inférieur ( IMC ) et à un rapport taille / hanches ainsi qu’à une obésité abdominale moindre (Fig. 4A). De plus, des niveaux plus élevés de métabolites de la taurine ont été associés à une prévalence plus faible de diabète de type 2 et à des taux de glucose inférieurs (Fig. 4A). De plus, des niveaux plus élevés de taurine et d’hypotaurine ont été associés à des niveaux inférieurs de protéine C-réactive marqueur d’inflammation ( CRP ). Pour les traits liés au foie et aux lipides tels que l’aspartate aminotransférase ( AST ) et le cholestérol sanguin, nous avons trouvé des associations positives avec les niveaux de taurine mais des associations négatives avec celles de son précurseur hypotaurine (Fig. 4A). Les paramètres des cellules sanguines comme l’hémoglobine, les plaquettes et le nombre de globules blancs étaient corrélés positivement avec les trois métabolites de la taurine (Fig. 4A). L’association n’établit pas de causalité, mais ces résultats sont cohérents avec une carence en taurine contribuant au vieillissement humain.
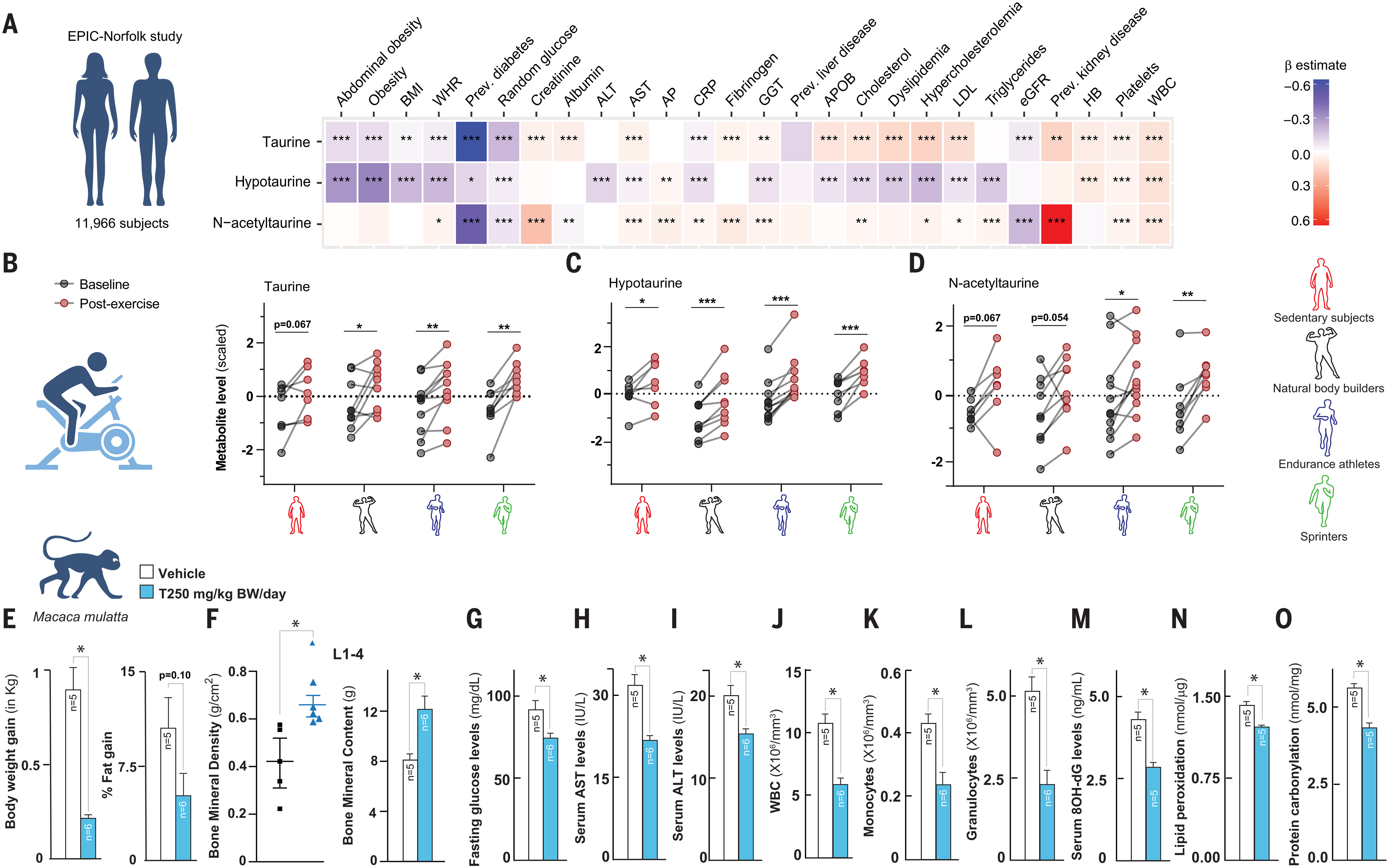
Fig. 4. La voie de la taurine affecte la portée de santé chez les primates.
(A) Feuille de chaleur montrant les résultats des modèles de régression linéaire pour évaluer les associations entre les facteurs de risque cliniques et les métabolites liés à la taurine ( taurine, hypotaurine, et N-acétyltaurine ) dans le sang de 11 966 sujets dans l’étude EPIC-Norfolk. La taille et la direction des effets de ces associations sont données par les estimations β résultant de ces modèles de régression. Une estimation β négative ( couleur bleue ) indique une association inverse, où des niveaux plus élevés d’un métabolite étaient corrélés avec des niveaux inférieurs d’un paramètre clinique. Une estimation β positive ( couleur rouge ) indique une association positive, où des niveaux plus élevés d’un métabolite étaient corrélés avec des niveaux plus élevés d’un paramètre clinique. Par exemple, comme le montre le bleu, des niveaux plus élevés de taurine étaient corrélés à une prévalence plus faible de diabète de type 2. Les métabolites liés à la taurine ont été mesurés à l’aide d’une approche métabolique non ciblée ( Plateforme Métabolon HD4 ). Les données ont été extraites du serveur Web en libre accès situé à https://omicscience.org/apps/mwasdisease/. AP, phosphatase alcaline; APOB, apolipoprotéine B; eGFR, taux de filtration glomérulaire estimé; GGT, γ-glutamyl transférase; HB, hémoglobine; LDL, lipoprotéine de basse densité; WHR, rapport taille / han. (B à D) Taurine sérique ( B ), hypotaurine ( C ), et N-acétyltaurine ( D ) niveaux au repos à jeun ( ligne de base ) et 5 min après un test d’exercice gradué maximum ( poste ) dans trois groupes d’athlètes de compétition et de sujets sédentaires sains. Les niveaux de métabolite sont fournis comme z-scores, c’est-à-dire par rapport à la moyenne des niveaux mesurés avec la moyenne = 0 et l’écart type = 1. (E à O) Gain de poids corporel en kilogrammes et pourcentage de gain de graisse ( E ); densité et teneur en minéraux osseux dans la colonne lombaire ( L1 à L4 ) ( os ) ( F ); taux de glucose à jeun ( fonction pancréas ) ( G ); taux sériques d’AST et d’ALAT ( marqueurs de dysfonctionnement hépatique ) [ H ( et ) I ( ); WBC, monocyte, et nombres de granulocytes ( immunophénotypage dans le sang ) [ ( J ) à ( L ) ]; et 8-OH-dG sérique, peroxyde de lipides, et niveaux de carbonyle protéique ( marqueurs indirects des dommages moléculaires induits par ROS ) [ M ( à ) O ( ) chez des singes de 15 ans nourris oralement une fois par jour avec véhicule ] T0 ( ou taurine < pendant 6 mois. Les détails de l’analyse statistique sont les suivants: Pour ( A ), statistiques sommaires, y compris les coefficients de régression normalisés ( β estimations ) et nominaux p des valeurs, sur un sous-ensemble pertinent de 26 traits cliniques et trois métabolites liés à la taurine ont été extraits d’un serveur Web. Coefficients de régression et nominaux p les valeurs ont été tracées dans une carte thermique en utilisant la version R 4.1.0. Pour la cohorte d’exercice [ ( B ) à ( D ) ], les différences entre les niveaux de métabolite de base et de post-exercice ont été analysées par groupe de sujets à l’aide d’un échantillon apparié t test. Les corrections de lots ont été effectuées à l’aide de la version R 4.1.0; les graphiques ont été préparés à l’aide de GraphPad Prism. Pour [ ( E ) à ( O ) ], une analyse statistique a été effectuée avec Graph Pad Prism 7 en utilisant Student’s t test ou ANOVA unidirectionnelle ou bidirectionnelle. Toutes les valeurs sont des moyennes ± SEM. p ≤ 0,001***, p ≤ 0,01 **, et p≤ 0,05 * sont contre WT ou contrôle.
Un épisode d’exercice augmente l’abondance de la taurine et de ses métabolites
Nous avons ensuite examiné si les taux sanguins de métabolites des voies taurines réagissent à l’exercice, ce qui améliore de nombreuses variables liées à la santé et au vieillissement (67, 68). Plus précisément, nous avons analysé les concentrations de métabolites de la voie taurine dans le sérum avant et après un test d’exercice gradué chez les athlètes masculins ( sprinters, les coureurs d’endurance et les culturistes naturels ) et les individus sédentaires ( fig. S7C ). Les niveaux de taurine ont considérablement augmenté ( 1,16 fois ) en réponse à un test d’exercice de cycle gradué dans tous les groupes d’athlètes étudiés (pmusculation = 0,046, pendurance = 0,0021, psprint = 0,0017 ) (Fig. 4B) et avait tendance à être plus élevé chez les sujets sédentaires, bien que le changement ne soit pas significatif (psédentaire = 0,067 ) (Fig. 4B). Les niveaux d’hypotaurine ont été considérablement multipliés par 1,36 en réponse à l’exercice chez tous les sujets (Fig. 4C). Niveaux de N-acétyltaurine a été significativement augmentée de 1,18 et 1,28 fois chez les athlètes d’endurance (p = 0,027 ) et sprinters (p = 0,0016 ), respectivement, et avait tendance à être élevé chez les culturistes et les sujets sédentaires, bien que le changement ne soit pas significatif (pculturistes = 0,054, psédentaire = 0,067 ) (Fig. 4D). Ces résultats sont cohérents avec l’idée qu’une augmentation de la taurine et des métabolites liés à la taurine pourrait servir de médiateur à certains des avantages de l’exercice pour la santé.
La supplémentation en taurine améliore les paramètres de santé des primates non humains d’âge moyen
Pour tester si la taurine a des effets sur la santé et l’anti-âge chez les primates non humains, nous avons nourri des singes rhésus âgés ( 15 ± 1,5 ans, équivalent à 45 à 50 ans chez l’homme ) solution témoin ou taurine [ 250 mg par kg de poids corporel ( T250 ), équivalent à T1000 chez la souris ] à 10:00 h une fois par jour pendant 6 mois, puis mesuré les variables de santé ( fig. S7D ). Avant le début de la supplémentation en taurine, le poids corporel et la densité osseuse n’étaient pas significativement différents dans les deux groupes de singes âgés ( fig. S7, E et F ). Trois heures après l’alimentation orale, les concentrations sériques de taurine chez les singes nourris à la taurine étaient environ deux fois ( 65,4 ± 10,1 ng / ml ) que chez les témoins ( 35,1 ± 7,3 ng / ml ). Les singes qui ont reçu de la taurine ont gagné 0,75 kg de poids corporel en moins, et leur pourcentage de graisse a eu tendance à être plus faible par rapport à celui des témoins (Fig. 4E). L’analyse d’absorptiométrie à rayons X à double énergie dans la vie ( DEXA ) après 6 mois de traitement à la taurine a montré que la taurine augmentait la densité osseuse et la teneur en colonne lombaire ( L1 à L4 ) et les jambes, mais pas dans la tête, chez les singes traités à la taurine par rapport aux singes témoins (Fig. 4F et fig. S7, G et H ). Les marqueurs sériques de formation osseuse ( ostéocalcine ) ont augmenté, tandis que ceux de résorption [ C-télopeptide terminal de collagène de type 1 ( Ctx ) ] ont diminué environ 16 semaines après le début du traitement; ces niveaux ont été maintenus jusqu’à la fin de la période de dosage ( fig. S7, I et J ). Le traitement par la taurine a réduit les concentrations de glucose dans le sang à jeun de 19% (Fig. 4G). La taurine a également réduit les concentrations sériques des marqueurs de lésions hépatiques AST et de l’alanine transaminase ( ALT ) de ~ 36 et 20%, respectivement (Fig. 4, H et moi). Le nombre de globules blancs, de monocytes et de granulocytes, qui augmentent avec l’âge, a diminué de ~ 50% chez les singes traités à la taurine par rapport aux singes témoins (Fig. 4, J à L). Conformément à l’effet bénéfique de la taurine sur la santé mitochondriale observée chez les vers et les souris, marqueurs indirects des dommages moléculaires induits par le ROS — ADN 8OH-dG, peroxyde de lipides, et les concentrations de protéines carbonyle — ont été diminuées respectivement de ~ 36, 11 et 20% dans les sérums de singes supplantés par la taurine (Fig. 4, M à O). Ainsi, la taurine a des effets bénéfiques sur la plupart des paramètres de santé testés ( poids corporel, os, glucose, foie et immunophénotype ) chez les primates non humains.
Discussion
L’abondance de taurine diminue dans le sang et les tissus pendant le vieillissement. Nous avons constaté qu’un renversement de ce déclin par supplémentation en taurine augmentait les marqueurs de la durée de vie saine chez les vers et les souris ainsi que la durée de vie des singes, qui identifie la carence en taurine comme un moteur du vieillissement de ces espèces. Chez la souris, l’effet de la supplémentation en taurine sur une durée de vie saine était plus important chez les femmes que chez les hommes, ce qui indique que les voies sexospécifiques peuvent servir de médiateur à l’action de la taurine. La dose optimale de taurine pour maximiser son efficacité différait selon les fonctions physiologiques testées, ce qui était peut-être dû à une grande variation du taux d’absorption, la synthèse, et métabolisme de la taurine dans différents fluides et tissus biologiques (24, 69–76).
La taurine semblait affecter toutes les caractéristiques établies du vieillissement. Bien que nous ne connaissions pas encore les événements initiaux que la taurine provoque, nous fournissons des preuves de la taurinylation supprimée des ARNt mitochondriaux pendant le vieillissement dans la dysfonction mitochondriale, une caractéristique importante du vieillissement. Il est également possible que d’autres biomolécules dérivées de la taurine en plus de l’ARN- τm5U puissent affecter directement ou indirectement l’homéostasie mitochondriale ou d’autres caractéristiques de vieillissement. En effet, la taurine contribue à la production de plusieurs autres biomolécules, selon le ou les types de cellules qui affectent, ou peuvent potentiellement affecter, le vieillissement (24). Ces molécules incluent N-chlorotaurine (77), sulfure d’hydrogène ( H2S ) (78), acide iséthionique (24), N-acétyltaurine (79) et 5-taurinométhyl-2-thiouridine ( τm5s2U ) -tRNALys (24). Nous proposons qu’une combinaison de biomolécules dérivées de la taurine et de la taurine puisse retarder le vieillissement en affectant diverses caractéristiques de vieillissement dans des cellules et des tissus distincts.
Les effets de l’intervention de la taurine sur le vieillissement et la carence congénitale en taurine dans un modèle de souris sont largement cohérents, à l’exception de l’accumulation de poids corporel et de l’homéostasie du glucose (Fig. 2 et fig. S5 ). Les concentrations de taurine dans le sérum et les tissus des souris congénitalement déficientes en taurine sont plus sévèrement réduites que dans les fluides et tissus biologiques des rongeurs et des humains âgés (23, 27, 80). Cependant, dans le foie, les concentrations de τm5U, un conjugué en aval de taurine, ont été également affectées. Ainsi, au début de la vie, la taurine semble être essentielle pour l’homéostasie dans plusieurs systèmes d’organes, et sa carence en développement peut compromettre ces fonctions postnatalement. Conformément à cette hypothèse, les organismes ont une concentration de taurine trois à quatre fois plus élevée dans les tissus embryonnaires que dans les tissus adultes; de plus, une carence en taurine pendant le développement entraîne un retard de croissance, une cécité, et ostéoporose (25, 81), et sa supplémentation pendant la gestation a augmenté la masse osseuse postnatalement ( fig. S5X ). Ce rôle de la taurine dans les tissus embryonnaires qui affecte les phénotypes postnataux serait cohérent avec la théorie de l’origine développementale des phénotypes vieillissants (82, 83). Il est possible que des changements développementaux ou postnatals du métabolisme de la taurine affectent le taux de vieillissement en fin de vie, et l’ajustement de cette machine endogène pourrait prolonger la durée de vie saine.
Chez l’homme, des niveaux inférieurs de métabolites de la voie taurine ont été associés à plusieurs maladies liées à l’âge, telles que l’obésité, le diabète et l’inflammation (Fig. 4A). Dans la base de données FinnGen ( Freeze R5 ), polymorphismes du gène de biosynthèse de la taurine, CSAD, sont associés à une hypertension ( fig. S7K ), et SLC6A6 les mutations provoquent une dégénérescence rétinienne et une cardiomyopathie (26, 84). Cependant, la supplémentation en taurine chez les sujets présentant des anomalies métaboliques n’affecte pas l’IMC (85). De plus, nos résultats, ainsi que ceux des études précédentes (86, 87), montrent que les concentrations de taurine augmentent chez les hommes en bonne santé après un exercice d’endurance aigu et après 24 semaines de formation à l’exercice chez les personnes obèses. Bien que les mécanismes qui augmentent les concentrations de taurine sanguine après l’exercice ne soient pas clairs, ces résultats suggèrent que certains des avantages pour la santé de l’exercice peuvent s’expliquer par une augmentation des concentrations de taurine sanguine.
Une limitation de notre étude est que nous n’avons pas testé l’effet de la taurine chez les singes mâles, et nos études d’association chez l’homme n’ont pas fait de distinction entre les sexes. Néanmoins, avec nos études de supplémentation chez des singes de 15 ans, les résultats présentés dans ce travail suggèrent qu’une augmentation des concentrations de taurine ou de ses actions peut avoir le potentiel de supprimer le déclin des fonctions biologiques qui se produit pendant le vieillissement humain.
L’inversion de la carence en taurine pendant le vieillissement peut être une stratégie anti-âge prometteuse. Étant donné que la taurine n’a aucun effet toxique connu chez l’homme ( bien que rarement utilisée dans les concentrations utilisées ici ), peut être administrée par voie orale et affecte toutes les principales caractéristiques du vieillissement, des essais humains sont justifiés pour examiner si la supplémentation en taurine augmente la durée de vie saine chez l’homme.
Résumé des méthodes
Analyse de la durée de vie
souris
Une analyse de la durée de vie a été effectuée chez des souris d’âge moyen qui ont reçu une supplémentation orale une fois par jour en taurine avec ou sans autres interventions.
Levure
RLS de levure a été évalué sur des plaques YPD riches en nutriments ou sur un milieu synthétique avec ou sans taurine.
Vers
La durée de vie des vers a été évaluée sur des plaques de gélose complétées par de la taurine ou sans.
Analyse de la durée de la santé
Les fonctions et la santé de divers organes chez les souris et les singes d’âge moyen ont été évaluées après supplémentation en taurine et comprenaient les éléments suivants: poids corporel; poids de la graisse; histologie osseuse et mesures µCT ou DEXA osseuses; tests de rotarod, de suspension de fil et de résistance à l’adhérence de la résistance neuromusculaire; tests de tolérance au glucose et à l’insuline de l’homéostasie du glucose; suspension de queue, boîte à lumière noire, et tests de comportement du labyrinthe Y; Tests de transit GI; tests de dépenses énergétiques; et numération sanguine des cellules immunitaires. Les caractéristiques de vieillissement ont été évaluées chez des souris d’âge moyen WT complétées par de la taurine, des souris déficientes en taurine, du poisson zèbre déficient en télomérase et des vers. Cette analyse comprenait des évaluations de la sénescence par coloration SA β-Gal, marqueurs SASP, irradiation et intervention sénolytique chez des souris déficientes en taurine;Dommages à l’ADN en utilisant des marqueurs moléculaires et des tests de létalité induits par le paraquat; fonction télomère en utilisant l’expression de la télomérase chez la souris et les zébrafishes et dans les zébrafish déficients en télomérase; changements épigénétiques basés sur le CpG et les méthylations d’histone; détection et protéostase des nutriments grâce à des mesures de phospho-RS6P, à une analyse des marqueurs d’autophagie par abondance de LC3A / B et à une intervention de rapamycine chez des souris déficientes en taurine; et fonction mitochondriale à travers des mesures ROS. De plus, des évaluations de la chaîne de transport d’électrons, du Western blotting des protéines OXPHOS et des tests de roténone ont été effectués dans les vers; les cellules souches ont été évaluées à l’aide détection et protéostase des nutriments grâce à des mesures de phospho-RS6P, à une analyse des marqueurs d’autophagie par abondance de LC3A / B et à une intervention de rapamycine chez des souris déficientes en taurine; et fonction mitochondriale à travers des mesures ROS. De plus, des évaluations de la chaîne de transport d’électrons, du Western blotting des protéines OXPHOS et des tests de roténone ont été effectués dans les vers; les cellules souches ont été évaluées à l’aide détection et protéostase des nutriments grâce à des mesures de phospho-RS6P, à une analyse des marqueurs d’autophagie par abondance de LC3A / B et à une intervention de rapamycine chez des souris déficientes en taurine; et fonction mitochondriale à travers des mesures ROS. De plus, des évaluations de la chaîne de transport d’électrons, du Western blotting des protéines OXPHOS et des tests de roténone ont été effectués dans les vers; les cellules souches ont été évaluées à l’aide Lgr5hybridation in situ; et les niveaux de cytokines ont été mesurés dans le sang. Une analyse par association humaine des métabolites de la voie taurine avec des variables de santé a été réalisée chez des individus de l’étude EPIC-Norfolk. La taille et la direction des effets de ces associations sont données par les estimations β résultant de ces modèles de régression. Une estimation β négative indique une association inverse, où des niveaux plus élevés d’un métabolite étaient corrélés avec des niveaux inférieurs d’un paramètre clinique. Une estimation β positive indique une association positive, où des niveaux plus élevés d’un métabolite étaient corrélés avec des niveaux plus élevés d’un paramètre clinique. L’effet de l’exercice sur les taux sériques de métabolites de la voie de la taurine chez l’homme a été évalué avant et après un test d’endurance chez les athlètes ( sprinteurs, les culturistes et les coureurs de marathon ) et les individus sédentaires.Un compte rendu détaillé des méthodes et des analyses statistiques utilisées dans cette étude est fourni dans le matériel supplémentaire.
Remerciements
Nous remercions D. Renn pour l’histologie, H. Liu pour génotypage, S. Abandon pour les expériences de singe, et G. Karsenty et V. Mahajan pour les installations. V.K.Y. consacre cette étude à la mémoire de sa mère, Bhagwanti Devi, pour avoir montré le chemin de la persévérance.
Financement:Ce travail a été financé par un Nathan Shock Center of Excellence dans la subvention de projet de biologie de base du vieillissement ( V.K.Y. ); Instituts nationaux de santé ( NIH ) R01HD107574 ( V.K.Y. ); Wellcome 098051 ( V.K.Y. ); Deutsche Forschungsgemeinschaft ( DFG ) 450149205-TRR333 / 1 ( P.B., H.W. ); NIH P30AG013280 ( M.K. ); NIH T32AG066574 ( M.G.K. ); Institut National Du Cancer ( INCa ) PLBIO21-228 ( M.G.F. ); Conseil de recherches en sciences et en génie ( SERB ) STR / 2019/00064 ( A.M. ); Département de biotechnologie ( DBT ) BT / PR40325 / BTIS / 137/1/2020 ( B.K.B. ); une subvention pour impetus de longévité ( A.K. ); Bourse d’excellence de l’Académie de Finlande en génétique des maladies complexes nos. 312074, 336824 et 352793 ( A.P. ); La Fondation Sigrid Juselius ( A.P. ); un Larry L. Bourse de la Fondation Hillblom ( M.C. ); Agence victorienne du cancer ( VCA ) Fellowship nos. ECRF21036 ( S.M. ) et MCRF21002 ( B.P. );et une bourse DBT Ramalingaswamy ( V.K.Y. ).
Contributions de l’auteur:Conceptualisation: V.K.Y.; Enquête: P.S., K.G., S.M., D.S., M.A.Y., M.C., B.L.B., A.N., S.L.S., A.Ri., E.M.V., A.F., T.N., A.J., J.D., J.Z.W., C.Q.N., M.M., M.G.K., K.S., S.J.C., S.R., S.K., A.Ra., M.S., F.I., G.d.L., A.G., R.K., A.S.C., A.S., N.C., B.K.B., P.N., V.V., A.M.A., V.K.Y.; Analyse et interprétation: D.S., P.S., M.C., K.G., S.M., M.A.Y., B.L.B., A.N., S.L.S., A.Ri., E.M.V., A.F., T.N., A.J., J.D., J.Z.W., C.Q.N., M.M., M.G.K., K.S., S.J.C., S.R., A.Ra., P.B., M.S., F.I., G.d.L., A.G., R.S., C.K., A.S.C., A.C., B.K.B., S.G., P.N., A.M., N.S., V.V., A.P., B.K.K., C.S., K.L.T., M.P., A.T.P., A.K., M.G.F., JK.A., GJ.L., A.M.A., M.K., H.W., B.P., V.K.Y.; Acquisition de financement: V.K.Y.; Administration du projet: V.K.Y., H.W., B.P., M.K., G.K.; Supervision: V.K.Y., H.W., G.K., B.P., M.K., A.M., B.K.B., S.G., M.G.F., M.C.; Rédaction – projet original: V.K.Y.; Rédaction et édition –: V.K.Y., H.W., M.A.Y., B.P., G.K., M.K., D.S., A.M., P.S., M.C., K.G., S.M.
Intérêts concurrents: Columbia University a déposé des demandes de brevet provisoires sur lesquelles V.K.Y. est répertorié comme inventeur. Les auteurs restants ne déclarent aucun intérêt concurrentiel.
Disponibilité des données et des matériaux: Toutes les données sont disponibles dans le texte principal ou les documents supplémentaires. Les codes utilisés pour l’analyse des données sont stockés publiquement sur github main_taurine.R à https://github.com/stemangiola/singh_et_al_taurine_bone/blob/master/main_taurine.R. Des comptes échelonnés de séquençage ont été déposés à Zenodo (88).
Informations sur la licence: Copyright © 2023 les auteurs, certains droits réservés; titulaire exclusif American Association for the Advancement of Science. Aucune prétention au gouvernement américain d’origine ne fonctionne. https://www.sciencemag.org/about/science-licenses-journal-article-reuse
Matériaux supplémentaires
Ce fichier PDF comprend:
- TÉLÉCHARGER
- 32,85 Mo
Les autres documents supplémentaires pour ce manuscrit sont les suivants:
Liste de contrôle de reproductibilité MDAR
- TÉLÉCHARGER
- 132,73 Ko
Références et notes
1
Département des affaires économiques et sociales des Nations Unies, Division de la population, “ Vieillissement de la population mondiale 2019: Faits saillants ” ( ST / ESA / SER.A / 430, Nations Unies, 2019 ); https://www.un.org/en/development/desa/population/publications/pdf/ageing/WorldPopulationAgeing2019-Highlights.pdf.
2
G. V. Mkrtchyan, K. Abdelmohsen, P. Andreux, moi. Bagdonaite, N. Barzilai, S. Brunak, F. Cabreiro, R. de Cabo, J. Campisi, A. M. Cuervo, M. Demaria, C. Y. Ewald, E. F. Fang, R. Faragher, L. Ferrucci, A. Freund, C. G. Silva-García, A. Georgievskaya, V. N. Gladyshev, D. J. Verre, V. Gorbunova, A. de Gray, W.-W. Lui, J. Hoeijmakers, E. Hoffmann, S. Horvath, R. H. Houtkooper, M. K. Jensen, M. B. Jensen, A. Kane, M. Kassem, P. de Keizer, B. Kennedy, G. Karsenty, D. W. Lamming, K.-F. Lee, N. MacAulay, P. Mamoshina, J. Mellon, M. Molenaars, A. Moskalev, A. Mund, L. Niedernhofer, B. Osborne, H. H. Pak, A. Parkhitko, N. Raimundo, T. A. Rando, L. J. Rasmussen, C. Reis, C. G. Riedel, A. Franco-Romero, B. Schumacher, D. UNE. Sinclair, Y. Suh, P. R. Taub, D. Toiber, J. T. Treebak, D. R. Valenzano, E. Verdin, J. Vijg, S. Young, L. Zhang, D. Bakula, A. Zhavoronkov, M.Scheibye-Knudsen, ARDD 2020: Des mécanismes de vieillissement aux interventions. Vieillissement12, 24484 – 24503 ( 2020 ).
3
RÉ. Gems, L. Perdrix, Génétique de la longévité dans les organismes modèles: Débats et changements de paradigme. Annu. Rev. Physiol.75, 621 – 644 ( 2013 ).
4
J. Campisi, P. Kapahi, G. J. Lithgow, S. Melov, J. C. Newman, E. Verdin, Des découvertes dans la recherche sur le vieillissement à la thérapeutique pour un vieillissement en bonne santé. Nature571, 183 – 192 ( 2019 ).


